Dampfdruckkurve und Phasendiagramm von Wasser
Bild
Diagramme:
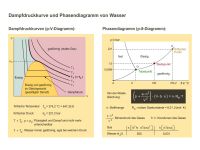
Die Dampfdruckkurven (p-V-Diagramm) und das Phasendiagramm (p-T-Diagramm) von Wasser werden gegenübergestellt.
Medientyp:
Bild (230,1 kByte)
Letzte Aktualisierung:
23.01.2023
Lizenz:

Dieses Medium steht unter einer CC BY-SA 4.0 international Lizenz.
Was bedeutet das?
So verweisen Sie auf das Medium

Dieses Medium steht unter einer CC BY-SA 4.0 international Lizenz.
Was bedeutet das?
So verweisen Sie auf das Medium
Beschreibung:
Erhitzt man Wasser bei atmosphärischem Normaldruck auf 100 °C, so entsteht Dampf. Wie wirkt sich aber eine Erhöhung oder Absenkung des Drucks auf die Verdampfungstemperatur aus?
Die Antwort geben die Dampfdruckkurve (T-Kurven im p-V-Diagramm links) und das Phasendiagramm (p-T-Diagramm rechts) des Wassers. Dampfdruck nennt man den Druck, bei dem Gas und Flüssigkeit im Gleichgewicht miteinander stehen, d. h., es verdampfen ebenso viele Moleküle wie auch wieder kondensieren. Oberhalb der kritischen Temperatur (Zahlenwerte sind angegeben) ist das Wasser, egal bei welchem Druck, immer gasförmig und es kann als reales Gas behandelt werden (Van-der-Waals-Gleichung, Formel ist angegeben). Unterhalb der kritischen Temperatur gibt es zu jeder Temperatur einen Dampfdruck, für den ein Zweiphasengebiet (flüssig und gasförmig) vorliegt. Im Bereich der flüssigen Phase kann man an der steilen Steigung der Kurven erkennen, das flüssige Substanzen kaum kompressibel sind.
Die kritische Temperatur darf nicht verwechselt werden mit der Temperatur des Tripelpunkts (siehe p-T-Diagramm). Er kennzeichnet die Werte von Temperatur und Druck, bei der alle Phasen (fest – flüssig – gasförmig) gleichzeitig vorliegen.
Hinweise und Ideen:
Bei welcher Temperatur kocht Wasser auf dem Mount Everest? Sog. „Dampfdrucktabellen“ geben Aufschluss darüber. Interessant wäre auch der Hinweis auf die Phasenwandlungspunkte als Haltepunkte der Temperatur. Beim Phasenübergang von flüssig nach gasförmig führt die zugeführte Energie zunächst nicht zur Temperaturerhöhung. Ebenso beim Schmelzen von Eis. Erst wenn alles Wasser verdampft bzw. geschmolzen ist, steigt die Temperatur weiter.
Die Antwort geben die Dampfdruckkurve (T-Kurven im p-V-Diagramm links) und das Phasendiagramm (p-T-Diagramm rechts) des Wassers. Dampfdruck nennt man den Druck, bei dem Gas und Flüssigkeit im Gleichgewicht miteinander stehen, d. h., es verdampfen ebenso viele Moleküle wie auch wieder kondensieren. Oberhalb der kritischen Temperatur (Zahlenwerte sind angegeben) ist das Wasser, egal bei welchem Druck, immer gasförmig und es kann als reales Gas behandelt werden (Van-der-Waals-Gleichung, Formel ist angegeben). Unterhalb der kritischen Temperatur gibt es zu jeder Temperatur einen Dampfdruck, für den ein Zweiphasengebiet (flüssig und gasförmig) vorliegt. Im Bereich der flüssigen Phase kann man an der steilen Steigung der Kurven erkennen, das flüssige Substanzen kaum kompressibel sind.
Die kritische Temperatur darf nicht verwechselt werden mit der Temperatur des Tripelpunkts (siehe p-T-Diagramm). Er kennzeichnet die Werte von Temperatur und Druck, bei der alle Phasen (fest – flüssig – gasförmig) gleichzeitig vorliegen.
Hinweise und Ideen:
Bei welcher Temperatur kocht Wasser auf dem Mount Everest? Sog. „Dampfdrucktabellen“ geben Aufschluss darüber. Interessant wäre auch der Hinweis auf die Phasenwandlungspunkte als Haltepunkte der Temperatur. Beim Phasenübergang von flüssig nach gasförmig führt die zugeführte Energie zunächst nicht zur Temperaturerhöhung. Ebenso beim Schmelzen von Eis. Erst wenn alles Wasser verdampft bzw. geschmolzen ist, steigt die Temperatur weiter.
Lernobjekttyp:
Veranschaulichung
Fächer:
Chemie; Physik; Technik
Klassenstufen:
Klasse 7 bis 9; Klasse 10 bis 13
Schultypen:
Berufliche Bildung; Weiterführende Schulen
Stichworte:
Aggregatzustand; Dampfmaschine; Diagramm; Energie; Turbine
Bibliographie:
Medienportal der Siemens Stiftung
Urheber/Produzent:
MediaHouse GmbH
Rechteinhaber:
© Siemens Stiftung 2023